時間:2022-08-23 來源: 作者: 我要糾錯
阿茲夫定三個遺傳毒性實驗均為陽性,動物實驗也發現了生殖毒性。這些給阿茲夫定是否適用于大部分不加干預也能自愈的新冠感染者打上了問號。當很多人提出疑慮時,包括藥監局工作人員在內的阿茲夫定支持者們卻在沒有公布詳細數據的情況下,大講不能離開劑量談毒性,說表現出毒性的劑量極高,陽性結果顯示的是“治療安全窗口”很大,不是存在風險。
首先,阿茲夫定連完整的臨床試驗結果都沒公布,比如三期臨床試驗實際招募多少人,是什么類型的患者,服藥時間多久,試驗終點有多少個,幾個顯示與安慰劑組有區別,這些都是未知。連治療效果是啥都沒個準信,說治療安全窗口很大,腦洞開得也過大了。
其次,劑量與毒性的關系雖然重要,但必須在整體收益風險的大局考量之下進行。遺傳毒性與生殖毒性是極為特殊的潛在風險,不僅要考慮使用劑量是否在這些實驗里是否陽性,更要考慮這種潛在風險是否值得,是否有必要去承受這些風險。不提全局收益風險,特別是新冠有其它沒有遺傳毒性生殖毒性風險的藥物可選,說阿茲夫定的陽性毒理結果不是問題,未免文過飾非。
再者,即使說劑量,阿茲夫定還真未必就沒問題。既然有人想用劑量來為阿茲夫定的遺傳毒性、生殖毒性辯護,我們今天就來好好看看這些劑量。
遺傳毒性劑量是人體劑量十萬倍?
先來看遺傳毒性劑量。阿茲夫定是三個遺傳毒性試驗——Ames,CHL染色體畸變與小鼠體內微核試驗均為陽性[1]。這些試驗在阿茲夫定HIV治療的上市評估報告中并未提及具體劑量。但藥監局工作人員以及阿茲夫定背后藥企卻稱Ames試驗里顯示陽性的劑量是“人體臨床劑量下血藥濃度的10萬倍”[2],想以此說明遺傳毒性陽性不是問題。
關于這個10萬倍的說法,我個人認為還是公布詳細數據為好。因為所謂血藥濃度10萬倍聽著挺好,但很難經得起推敲。血藥濃度有很多,是一次給藥之后的最高濃度,還是多次給藥之后最低維持濃度?
從評估報告看阿茲夫定服藥后個體血藥濃度差異極大,如果僅以4mg組為參考(新冠用藥為5mg)[1]:

給藥后最高血藥濃度(Cmax)大概是3.5-4.5ng/ml。如果Ames陽性是以此為10萬倍,那Ames實驗的藥物濃度用到了350-450ug/ml,對應分子濃度達1200uM(根據評估報告中HIV EC50的6.92nM對應1.98ng/ml推算)。實驗中能否做到這樣一個高濃度我還真挺懷疑的,因為過往一些文章顯示阿茲夫定對人體PBMC的半殺傷劑量在3uM左右[3],對多種腫瘤細胞生長抑制也在5uM以下[4]。雖說Ames是細菌,可能更耐操一些,但如果能做出個1200uM的實驗濃度,震撼程度也不亞于星爺的九品芝麻官里下毒用了一斤砒霜。另外,根據ICH遺傳毒性實驗的推薦(ICH也是辯解阿茲夫定毒理陽性結果沒問題的人喜歡引用的標準),最高濃度(溶解度能達到)也不過1000uM[5]。
而且阿茲夫定的遺傳毒性陽性不是Ames陽性一個實驗的問題。CHL染色體畸變是小鼠細胞的體外實驗,這個濃度根據藥監局的說法就只有人體血藥濃度的60倍了。
相較這兩個體外實驗,更為關鍵的是小鼠體內實驗,也就是在一個活的動物里觀察,這樣更能反映藥物在體內的吸收代謝等情況。ICH遺傳毒性評估指導里也明確說體外陽性結果需要用體內實驗確認,體內實驗更為重要。而體內實驗里阿茲夫定也是有遺傳毒性的。在這個更重要的陽性結果上,藥監局工作人員在為阿茲夫定發聲的時候反倒不說劑量是什么了。當然,根據阿茲夫定生殖毒性的技術評估部分[1],不難推斷遺傳毒性的體內實驗劑量不可能是啥10萬倍,不愿意拿出來說也可以理解。
生殖毒性劑量是臨床劑量60倍?
一個為阿茲夫定毒理實驗結果辯解的采訪中提到“CHL染色體畸變試驗中,生殖毒性實驗安全劑量下的藥物暴露量是臨床治療劑量下暴露量的60多倍”[2]。這句話充滿歧義,CHL染色體畸變是遺傳毒性的體外實驗,不知道怎么和生殖毒性聯系在了一起。遺傳毒性是看化學品是否會導致基因變異,生殖毒性是看是否對生殖力、胚胎發育有影響。
我們姑且猜測CHL與生殖毒性實驗都是臨床劑量暴露量的60倍。而阿茲夫定藥企據傳也稱生殖毒性實驗用的劑量是人體使用劑量的60倍,大概指的是一回事。
只不過劑量差距真的有60倍嗎?
從服藥劑量上來說,阿茲夫定用于新冠治療是5mg每天,據說是用藥7天——不好意思,還真沒找到藥監局或阿茲夫定的生產商說明到底是吃幾天,大概忙著告訴大家遺傳毒性生殖毒性沒問題,顧不上說療程是多久。
那么生殖毒性的動物使用劑量呢?
評判大鼠生育力影響的實驗[1]:

5mg/kg無論雌雄都嚴重影響生育率了吧——畢竟胚胎丟失率都上升了。如果以一個人體重60kg計算,倒還勉強是與一個人用5mg差了60倍。當然,很多年輕姑娘們未必有60kg重,這個大概藥監局不管了,是吧?
而且關鍵是NOAEL劑量,NOAEL是未觀察到毒性的最高劑量。在生殖毒性問題上,咱的標準應該不是不毒到徹底不孕不育都不算事吧?觀察到開始有問題的劑量就該警覺吧?白紙黑字,雌鼠生育力與胚胎發育的NOAEL是1.5mg/kg,按人體60kg計算,與人體使用劑量差距是18倍而非60倍吧?如前文所言,如果哪位姑娘輕一些,比如體重90斤的,就只有13.5倍了。
再來看看胚胎早期發育的影響[1]:

妊娠早期給大鼠喂藥,NOAEL是0.5mg/kg,60kg人體對應下來,只比人的服藥劑量高6倍。很安全嗎?要是體重輕一點,可連6倍都沒有——90斤體重對應只有4.5倍。
還有兔子的生殖毒性實驗[1]:

NOAEL是1mg/kg,還是按60kg人體體重算,劑量差異是12倍,不是60倍。
而大鼠妊娠晚期服藥[1]:

NOAEL對母鼠來說是0.5mg/kg,仍然只有6倍的空間。里面60倍劑量差的時候,也就是5mg/kg,母鼠直接掛了(母體死亡)。為阿茲夫定洗地的不要拐彎抹角瞎扯什么生殖毒性是人體使用60倍劑量,60倍都一尸兩命了。
這也是在遺傳毒性部分為什么我說小鼠體內致突變的劑量不會比人體高個10萬倍那么好看,劑量高個60倍,動物都未必能活到實驗完成那一天了。致突變的劑量沒一些人說得那么樂觀。
當然我們這里說的是給藥劑量,實際應考慮暴露的血藥濃度,畢竟不同動物藥物的吸收分布會有差異。可是這些阿茲夫定并沒有公開數據,自然無從論證,只不過無論兔子大鼠,生殖毒性都存在,也都只是人體使用劑量的6-12倍,缺乏更多數據不意味著我們可以放松警惕,反而要更加警覺。
不公布詳細數據,我們沒法判斷阿茲夫定治療新冠的療效,一些人吹得天花亂墜我們也只能通過藥物機理、疾病機理來提出懷疑,沒法實錘。但這些生殖毒性實驗結果可有政府網站上公開的文件,拜托就不要指鹿為馬了。
3.用藥時間短就沒問題?
阿茲夫定安全論的另一大理由是人體服藥時間短,遺傳毒性、生殖毒性陽性都無關緊要,畢竟藥物暴露時間短。
可這是真的嗎?我們來看一下之前生殖毒性實驗的服藥時間[1]:

大鼠兩個實驗服藥是7天,兔子是12天,服藥周期很長嗎?
阿茲夫定的新冠臨床試驗設計里對人體用藥是怎么樣的[6]:

最多用藥14天,好像和動物生殖實驗周期差不多啊?怎么就用藥周期短,陽性參考意義不大呢?就算現在以7天為治療周期,也和大鼠的生殖毒性實驗同一個周期啊。
更何況在過往文章里我也解釋過,遺傳毒性與生殖毒性是非常特殊敏感的,不可能去臨床試驗里看看有沒有這些問題。這些動物毒理實驗就是幫我們評估風險的。
即使觀察到的劑量在人體使用劑量之上,也要考慮到人群里存在個體差異,有些人藥物吸收特別好,說不定達到的濃度就會高一些——甚至阿茲夫定自己的技術評估報告里都有提到個體血藥濃度差異大。這些都意味著我們應該正視、警惕這樣的風險,而不是滿腦子想著大事化小。
要考慮阿茲夫定針對的疾病,是否有必要去冒這樣的風險?如果阿茲夫定今天申請的是治療晚期癌癥,那什么遺傳毒性、生殖毒性,都不是大問題,因為患者的情況意味著這些風險是可以承受的。新冠是嗎?
還要考慮是否有其它選擇?國家已經上市了安全且真實有效的新冠早期治療藥物——包括口服藥。接下來上市的藥物安全標準應該更嚴格才對。
劑量與毒性要在收益風險框架內討論
對于那些為阿茲夫定的遺傳毒性、生殖毒性辯解的,我感到非常不可思議的一點是,類似的問題默克的口服藥molnupiravir也遇到了。這些都是2021年11月FDA的molnupiravir外部專家會議里重點討論的問題。那個會議的材料甚至視頻錄像現在都能在網上找到。實在想不通的,干脆去參考FDA的討論就完了。
從遺傳毒性上來說,molnupiravir只有Ames陽性,動物實驗都是陰性,要說沒致突變風險,理由比阿茲夫定充分多了。
從生殖毒性上看,molnupiravir觀察到毒性的實驗動物藥物暴露量也高于人體使用劑量多倍[7]:
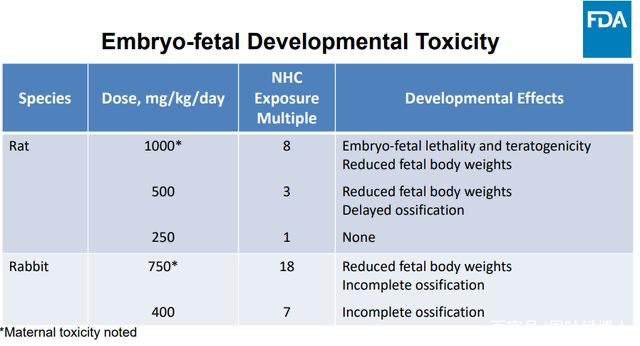
為什么最后FDA以及FDA找的外部專家沒一個說molnupiravir的遺傳毒性、生殖毒性不必多慮的?反而對molnupiravir的使用做了嚴格限制,不僅孕婦未成年人禁用,普通人群也必須是別的藥用不了才能使用。
FDA以及FDA找的專家連起碼的劑量毒性關系都不懂?就那些給阿茲夫定洗地的人懂?
說劑量毒性關系,至少也要先放在收益風險的大框架下才行。否則,我們是不是還要等煙草公司教育我們每天抽幾根煙是在安全劑量?
面對新冠,居然能批一個遺傳毒性、生殖毒性數據比有效性數據還多的藥。動物實驗開始顯示生殖毒性的劑量就是人體使用劑量的6倍,如果計算體重輕一些,搞不好更低。這種情況下,監管方不想著趕緊明確禁忌人群,反倒忙著幫藥企站臺洗地,想去藥企上班可以啊,先把公務員職位辭了,別玩身在曹營心在漢那一套。
參考資料:
https://file.wuxuwang.com/zhuce/ssypfiles/e5d36909ee1240d2e86b0c3a15e0ac29%E4%B8%8A%E5%B8%82%E5%AE%A1%E8%AF%84%E6%8A%A5%E5%91%8A.pdf
http://m.gxfin.com/article/finance/yy/default/2022-07-28/5856905.html
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4140803/
https://pubmed.ncbi.nlm.nih.gov/21219886/
https://www.ema.europa.eu/en/documents/scientific-guideline/ich-guideline-s2-r1-genotoxicity-testing-data-interpretation-pharmaceuticals-intended-human-use-step_en.pdf
https://clinicaltrials.gov/ct2/show/NCT05033145?term=AZVUDINE&draw=2&rank=2
https://www.fda.gov/media/154473/download
文章來源:周葉斌博士
無相關信息